RNase H依存オフターゲット効果を抑制する化学修飾核酸の開発
生命理工学院 助教 正木 慶昭
核酸医薬品は、化学合成により製造された核酸を用い、主にRNAを標的とすることができる医薬品です。どのようなタンパク質も、翻訳される前のRNAの段階ではAUGCの並び順が異なるだけのため、原理的にはあらゆるタンパク質を標的にできる医薬品の形態です。また遺伝性疾患に多く見られるスプライシング異常の修正など、核酸医薬品特有の治療アプローチが可能であるところも魅力的です。しかし、1978年に原理実証の論文が報告されて以来、認可されたRNAを標的とする核酸医薬品は7剤に過ぎません。これは核酸医薬品に特有の課題があるためです。
核酸医薬品の課題のひとつに安全性の担保があります。医薬品の安全性は、臨床試験の前段階である前臨床試験での動物試験により評価されます。しかし、動物とヒトでは、RNAの塩基配列が異なってきます。タンパク質をコードしているエキソンや機能性のRNAの配列は動物種間で似ている一方、そうでない配列は、ほとんど似ていません。そのため、核酸医薬品の一つであるRNaseH依存型アンチセンス核酸の場合では、標的でないRNAに作用するオフターゲット効果の影響を、動物試験で評価することが難しいです。このような背景から、我々はヒトでの安全性を原理的に高めるような方法論の構築に挑戦しています。
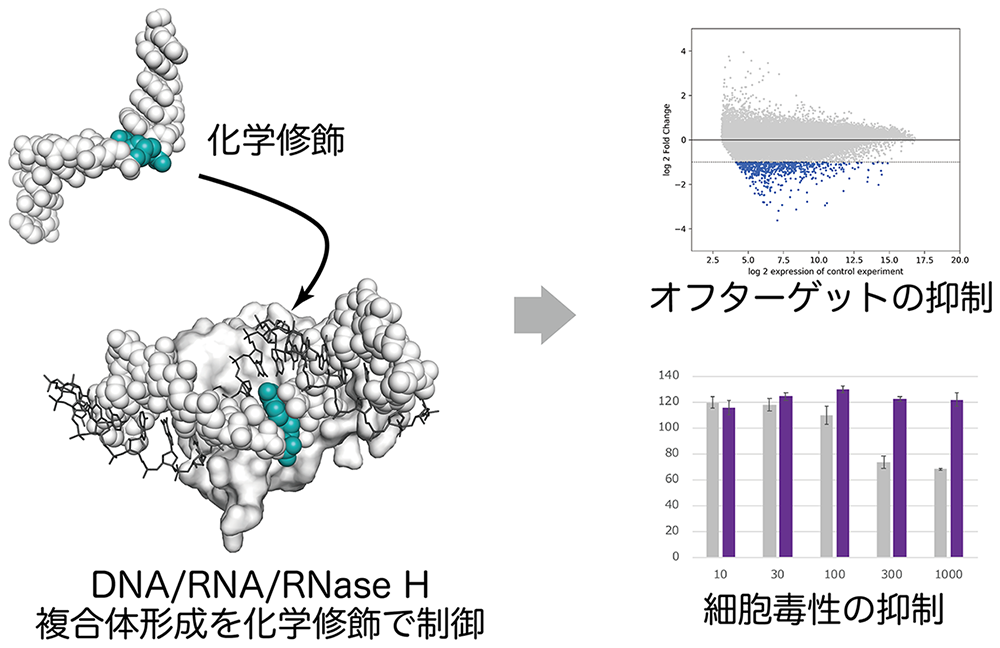
そのような方法論の構築にむけ、RNase H依存型アンチセンス核酸のオフターゲット効果を予測する手法をまず開発しました。その過程で、RNaseHが活性を示す最小条件を満たす切断可能部位の抑制が重要であることを見出しました。東工大TSUBAME 3.0スーパーコンピュータを用いたRNase H/DNA/RNA複合体の構造計算を通して、複合体形成によって誘起される構造変化を精査し、切断可能部位をコントロールする化学修飾の開発を行いました。第一世代の分子として開発した化学修飾核酸は、活性を損なうことなく、オフターゲット効果や細胞毒性といった副作用を、効果的に抑制することに成功しています。現在は、第一世代の開発分子の結果から見えてきた新たな課題の解決を通して、さらに安全性の高い核酸医薬品開発の創製に取り組んでいます。
お問い合わせ先
東京工業大学 研究・産学連携本部
E-mail:sangaku[at]sangaku.titech.ac.jp